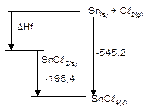1. Pernyataan yang benar tentang model atom mekanika kuantum adalah … .
A. Atom adalah partikel terkecil dari zat
B. Atom terdiri dari inti atom dan elektron
C. Atom merupakan bola pejal yang bermuatan positif dikelilingi elektron negatif
D. elektron dan atom dipandang sebagai partikel dari gelombang
E. Inti atom bermuatan positif yang terdiri dari proton dan neutron dikelilingi elektron negatif
2. Jumlah elektron maksimum dalam sub kulit d adalah … .
A. 2
B. 5
C. 6
D. 10
E. 14
3. Nomor atom Al = 13, maka kulit valensi dari atom unsur Al adalah … .
A. 3s
B. 3s dan 3p
C. 3s dan 3d
D. 3p dan 3d
E. 3p
4. Nomor atom unsur K = 19. Konfigurasi elektron ion K+ adalah … .
A. 1s2 2s2 2p6 3s2 3p6
B. 1s2 2s2 2p6 3s2 3p6 4s1
C. 1s2 2s2 2p6 3s2 3p6 4s2
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d1
E. 1s2 2s2 2p6 3s2 3p5
5. Konfigurasi elektron yang benar untuk unsur X dengan nomor atom 33 adalah … .
A. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
B. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
C. 1s2 2s2 2p6 3s2 3p6 3d10 4s1
D. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 3d1
E. 1s2 2s2 2p6 3s2 3p6 3d10 4p5
6. Atom suatu unsur mempunyai konfigurasi elektron: 2, 8, 5.
Bilangan kuantum elektron terakhir dari atom tersebut adalah … .
7. Pasangan unsur-unsur di bawah ini yang memiliki elektron valensi sama adalah … .
A. 4 Be dan 10 Ne
B. 3 Li dan 13 Al
C. 12 Mg dan 20 Ca
D. 9 F dan 19 K
E. 11 Na dan 21 Sc
8. Konfigurasi elektron unsur X adalah :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
Dalam sistem periodik unsur, X terletak pada ...
A. golongan IVA periode 4
B. golongan VIA periode 4
C. golongan IVB periode 4
D. golongan IVB periode 4
E. golongan VIIIA periode 4
9. Diketahui : nomor atom unsur P = 17
nomor atom unsur Q = 21
Dalam sistem periodik unsur P dan Q berturut-turut terdapat pada blok… .
A. s dan p
B. p dan s
C. s dan d
D. d dan p
E. p dan d
10. Diketahui konfigurasi elektron unsur berikut:
P : 1s2 2s1
Q : 1s2 2s2 2p3
R : 1s2 2s2 2p5
S : 1s2 2s2 2p6 3s2
T : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Pasangan unsur yang terletak dalam satu golongan adalah … .
A. P dan Q
B. P dan R
C. Q dan S
D. Q dan T
E. R dan T
11. Diketahui konfigurasi elektron :
X : 1s2 2s2 2p1
Y : 1s2 2s2 2p3
Z : 1s2 2s2 2p6 2s2 3p3
R : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
S : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Unsur yang tergolong logam adalah … .
A. X dan Y
B. X dan Z
C. Y dan Z
D. Z dan R
E. R dan S
12. Pasangan unsur berikut dalam sistem periodik unsur letaknya diagonal … .
A. 3Li dan 4Be
B. 11Na dan 19K
C. 6C dan 7N
D. 7N dan 15P
E. 13Al dan 32Ge
13. Pasangan senyawa berikut yang memiliki ikatan kovalen adalah … .
A. NaCl dan HCl
B. Na2O dan H2O
C. H2S dan H2O
D. K2O dan KCl
E. NaCl dan KCl
14. Jika atom pusat dinyatakan dengan X, domain elektron ikatan dengan Y dan domain elektron bebas dengan E, maka molekul berikut yang memiliki tipe XY4 adalah … .
A. CO2
B. H2O
C. NH3
D. CH4
E. SO2
15. Molekul atau senyawa yang antar molekulnya dapat membentuk ikatan Van der waals adalah … .
A. H2O
B. NH3
C. CH4
D. NaCl
E. CH3 – OH
16. Diketahui Mr HCl=36,5 dan momen dipol =1,08
Mr HI=128 dan momen dipol =0,38
Berdasar data tersebut dapat disimpulkan … .
A. HI lebih polar dibanding HCl
B. Ikatan hidrogen HI lebih kuat dibanding HCl
C. Sifat asam HCl lebih kuat dibanding HI
D. titik didih HI lebih tinggi dibanding HCl
E. Ikatan van der waals HCl lebih kuat dibanding HI
17. Senyawa berikut yang dapat membentuk ikatan hidrogen adalah … .
A. CH3 – O - CH3
B. CH3 – CH2 - OH
C. CH4
D. H2S
E. HCl
18. Persamaan reaksi berikut yang menunjukkan definisi perubahan entalpi pembentukan karbon monoksida adalah … .
19. Pada proses endoterm … .
A. kalor berpindah dari sistem ke lingkungan dan DH<0
B. kalor berpindah dari sistem ke ingkungan dan DH>0
C. kalor berpindah dari lingkungan ke sistem dan DH<0
D. kalor berpindah dari lingkungan ke sistem dan DH>0
E. tidak terjadi perpindahan kalor dan DH=0
20. Entalpi pembentukan MgSO4 (s) = -1278 kJ mol-1 maka persamaan termokimia pembentukan MgSO4 yang benar adalah … .
A. MgO(s) + SO3(g) ![]() MgSO4(s) DH= - 1278 kJ
MgSO4(s) DH= - 1278 kJ
B. Mg(s) + S(s) + 2O2(g) ![]() MgSO4(s) DH= - 1278 kJ
MgSO4(s) DH= - 1278 kJ
C. 2Mg(s)+2S(s)+4O2(g) ![]() 2MgSO4(s)DH=-2556 kJ
2MgSO4(s)DH=-2556 kJ
D. Mg2+ (aq)+ SO42-(aq) ![]() MgSO4(s) DH= - 1278 kJ
MgSO4(s) DH= - 1278 kJ
E. MgS(s) + 2O2(g) ![]() MgSO4(s) DH= - 1278 Kj
MgSO4(s) DH= - 1278 Kj
21. Dari diagram berikut :
maka harga DHf SnCl2(s) adalah … .
A. – 349,8 kJ/mol
B. +349,8 kJ/mol
C. +195,4 kJ/mol
D. -174,9 kJ/mol
E. +174,9 kJ/mol
22. Diketahui :
2C(grafit) + O2(g) ![]() 2CO(g) DH = - a kj/mol
2CO(g) DH = - a kj/mol
C(grafit) + O2 ![]() CO2(g) DH = - b kj/mol
CO2(g) DH = - b kj/mol
maka DH untuk reaksi CO(g) + ![]() O2(g)
O2(g) ![]() CO2(g)
CO2(g)
adalah …
A. (-a – b) kj/mol
B. (a – b) kj/mol
E. (a + 2b) kj/mol
23. Perubahan entalpi standar pembentukan gas etena dan gas etana berturut-turut adalah 52 kj/mol dan –85 kj/mol, maka perubahan entalpi untuk reaksi :
C2H4(g) + H2(g) ![]() C2H6(g) adalah … .
C2H6(g) adalah … .
A. –33 kj/mol
B. +33 kj/mol
C. –137 kj/mol
D. +137 kj/mol
E. –274 kj/mol
24. Diketahui :
DHf. CO2(g) = -394 kJ/mol
DHf. H2O(g) = -242 kJ/mol
DHf. C2H6(g) = -85 kJ/mol
maka perubahan entalpi pembakaran C2H6(g) adalah … .
A. – 714,50 kJ/mol
B. +714,50 kJ/mol
C. -1429,00 kJ/mol
D. +1429,00 kJ/mol
E. – 2858,00 kJ/mol
25. Diketahui :
CaO(s) + H2O(l) ![]() Ca(OH)2(s) DH = -350 kj/mol. Jika Ar C = 40; O = 16 maka kalor reaksi per gram kalsium oksida (CaO) yang direaksikan adalah … .
Ca(OH)2(s) DH = -350 kj/mol. Jika Ar C = 40; O = 16 maka kalor reaksi per gram kalsium oksida (CaO) yang direaksikan adalah … .
A. –6,25 Kj
B. +6,25 Kj
C. –62,40 Kj
D. -350 Kj
E. +350 Kj
26. Diketahui
N2(g) + 3H2(g) ![]() 2NH3(g) DH= - 107 kJ/mol
2NH3(g) DH= - 107 kJ/mol
jika energi ikatan :
H – H : 436 kJ/mol
maka energi ikatan rata-rata N-H dalam NH3 adalah … .
A. 393 kJ/mol
B. 642 kJ/mol
C. 782 kJ/mol
D. 2249 kJ/mol
E. 2346 kJ/mol
27. Diketahui energi ikat:
H – I = 299 kJ/mol
H – H = 436 kJ/mol
I – I = 151 kJ/mol
maka kalor yang diperkukan untuk menguraikan 256 gram HI (Ar H = 1; I = 127) menjadi unsur-unsurnya adalah … .
A. 5,5, kj
B. 11,0 kj
C. 22,0 kj
D. 44,0 kj
E. 88,0 kj
28. Diketahui energi ikatan rata-rata untuk
C – C : 348 kJ/mol C – Cl : 328 kJ/mol
C = C : 641 kJ/mol H – Cl : 431 kJ/mol
C – H : 413 kJ/mol
Maka perubahan entalpi reaksi
H2C = CH2 + HCl ![]() H3C – CH2 – Cl adalah … .
H3C – CH2 – Cl adalah … .
A. – 17 kJ
B. + 17 kJ
C. – 44 kJ
D. + 44 kJ
E. + 47 kJ
Kunci: DDBAB ECBED EECDC EBBDB ADCCA ABA